Western blot
背景知识
蛋白质印迹法(免疫印迹试验)
- 由瑞士米歇尔弗雷德里希生物研究所(Friedrich·Miescher·Institute)的Harry·Towbin在1979年提出的。在尼尔·伯奈特(Neal·Burnette)于1981年所著的《分析生物化学》(Analytical·Biochemistry)中首次被称为Western·Blot。
- 现已广泛应用于基因在蛋白水平的表达研究、抗体活性检测和疾病早期诊断等多个方面。
抗体(antibody)

- 1.·抗原结合区(Fab)
- 2.·抗原结晶区(Fc)
- 3.·蓝色的重链有一个可变区(VH),紧随其后的一个恒定区(CH1),一个枢纽区,以及另两个恒定区(CH2·and·CH3)组成
- 4.·绿色的轻链包含一个可变区(VL)以及一个恒定区(CL)
- 5.·抗原结合点
- 6.·枢纽区
应用范围
- 检测目的蛋白的抗原性
- 检测目的蛋白的分子量大小
- 从混合样品中检测目的蛋白
- 目的蛋白在不同样品中的表达量差异
- 经过不同处理后,目的蛋白的表达量的变化
- 确定目的蛋白的表达情况
- 研究蛋白间的相互作用
- 确定目的蛋白的细胞定位
基本原理
方法
- 聚丙烯酰胺凝胶电泳
被检测物
- 蛋白质
探针
- 抗体
显色
- 标记的二抗
转膜
- 经过PAGE(聚丙烯酰胺凝胶电泳)分离的蛋白质样品,转移到固相载体PVDF或NC膜上,固相载体以非共价键形式吸附蛋白质,且能保持电泳分离的多肽类型及其生物学活性不变
抗原抗体反应
- 以固相载体上的蛋白质或多肽作为抗原,与对应的抗体起免疫反应,再与酶或同位素标记的第二抗体起反应,经过底物显色或放射自显影以检测电泳分离的特异性目的基因表达的蛋白成分。该技术也广泛应用于检测蛋白水平的表达
内参
作用
- WB过程监测
- 目的蛋白定量的标准
意义
- 最重要和最不可或缺的对照
- 可检测整个WB实验过程及体系是否正常工作
- 如果一个实验连内参照都出不了阳性结果的话(在内参抗体有效的情况下),那么这个体系就是存在问题

- 起半定量的标准的作用
- 内参一般选择管家基因编码表达的蛋白,在很多组织和细胞中都是稳定表达的,因此可以作为检测靶蛋白表达量的标准
设备耗材
仪器耗材
实验药品试剂
裂解液
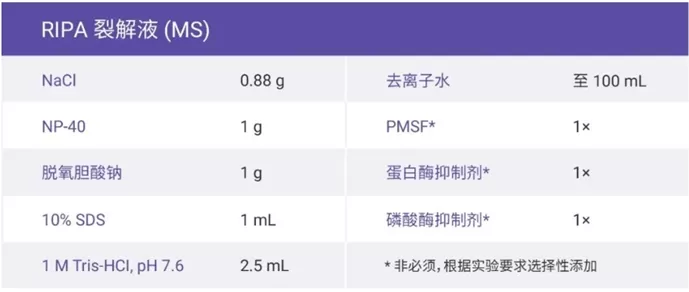
- 母液(动物组织蛋白提取Buffer):蛋白酶抑制剂:Pmsf(配)=100:1:1
- 母液常温放置;蛋白酶抑制剂和Pmsf需-20℃保存;裂解液需-4℃保存。
考马斯亮蓝染液
- 使用前用无菌水稀释
转膜液的配制(1*)1L
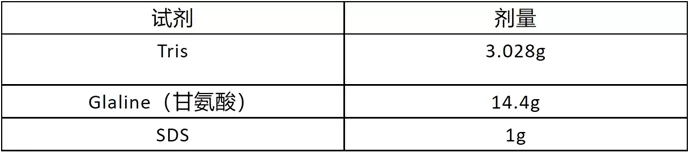
- 先定容800ml,调制PH=8.3,然后+200ml甲醇,混匀
蛋白电泳Buffer(5*)1L
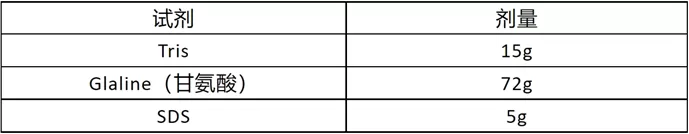
- 直接定容至1L,无需灭菌和调PH;使用前稀释至1*
磷酸盐缓冲液(PBS,10*)500ml
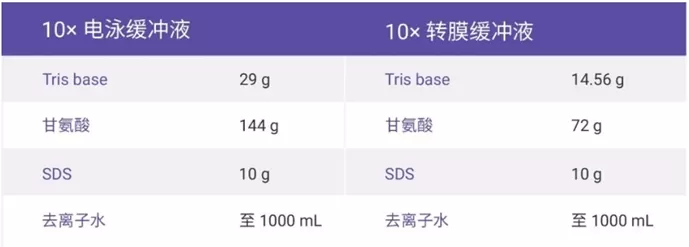
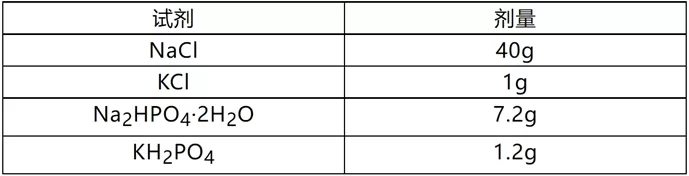
- 调制PH=7.4-7.5
PBST配制
- 1L的PBS+5ml·20%Tween20
封闭液(5%)
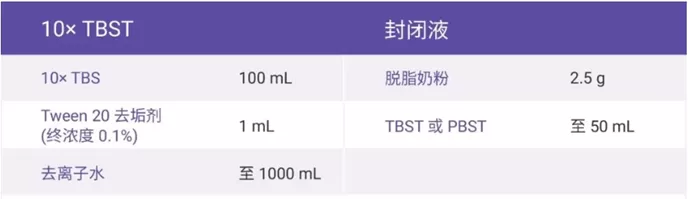
- 奶粉5g,溶于PBS,定容至1L。
- 注:推荐使用的奶粉:雀巢高钙奶粉或多力精低脂奶粉。
一抗溶于封闭液
二抗溶于PBST
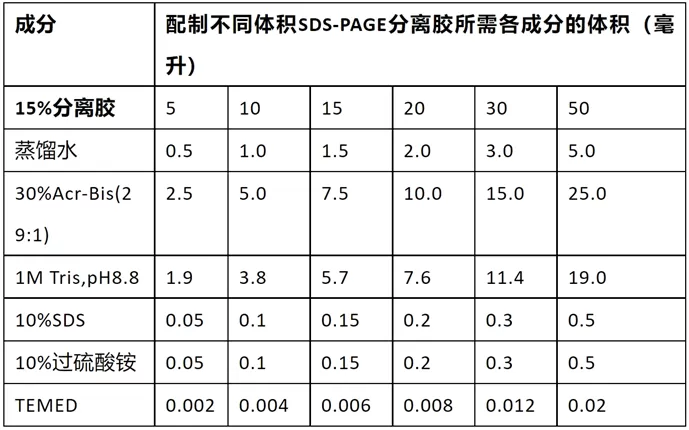
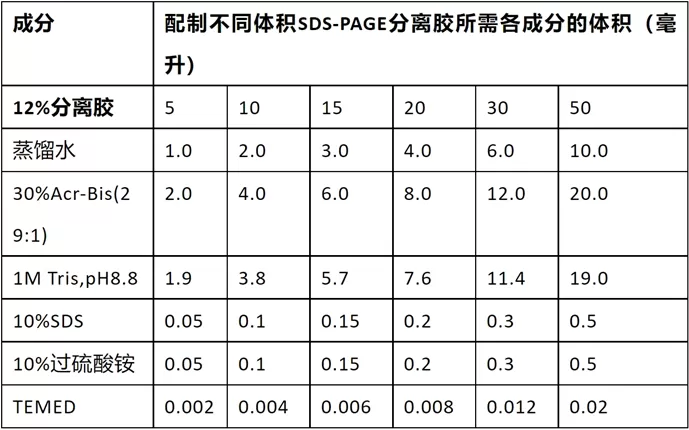
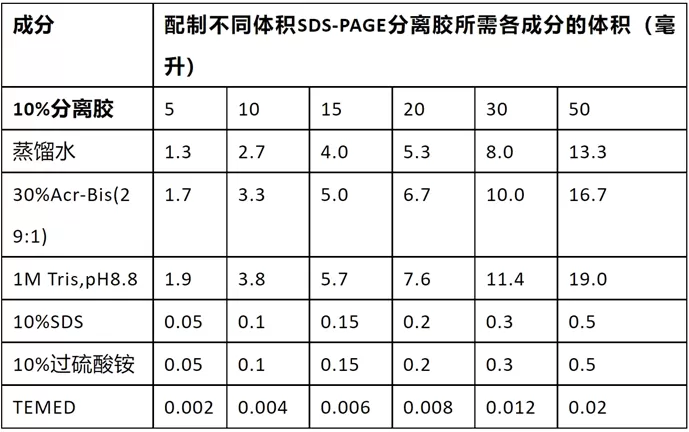
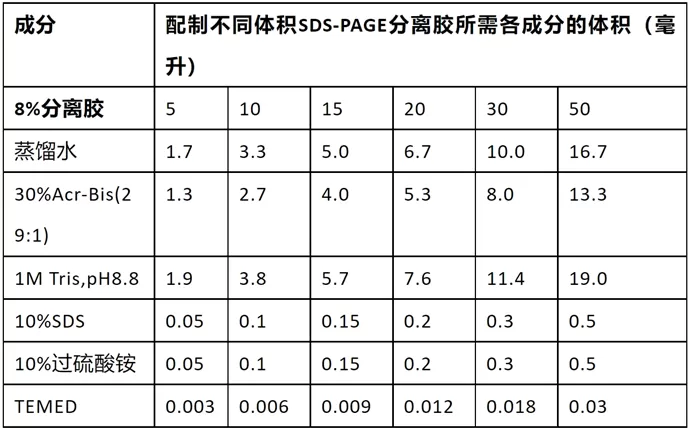
配制SDS-PAGE的浓缩胶
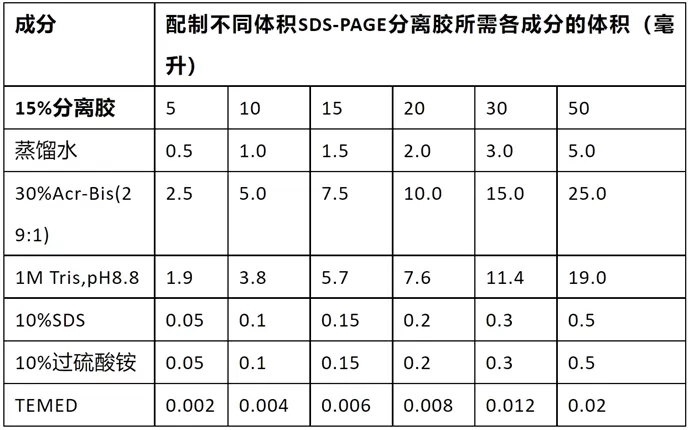
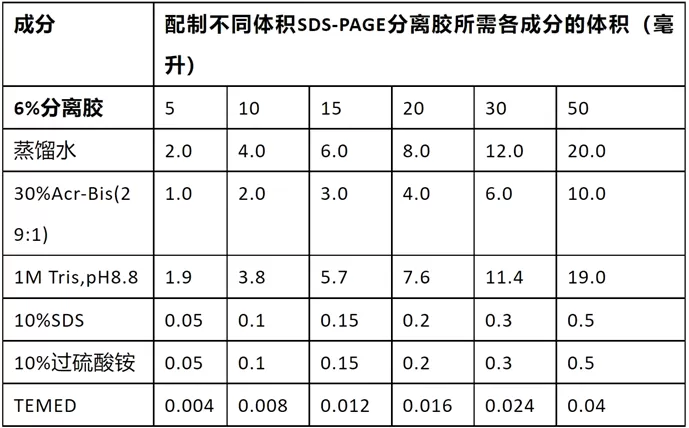
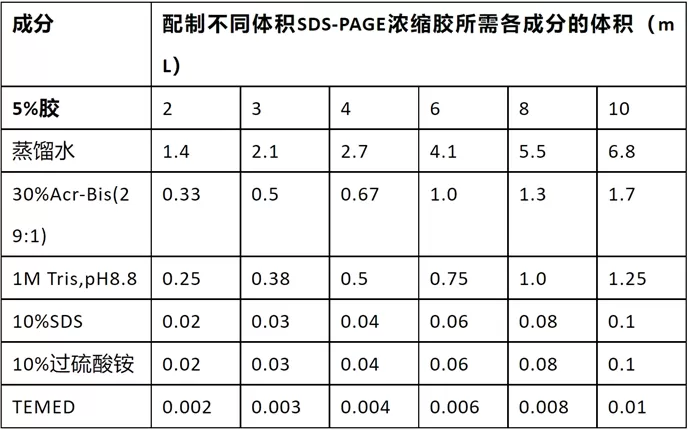
- 也称堆积胶、积层胶、上层胶
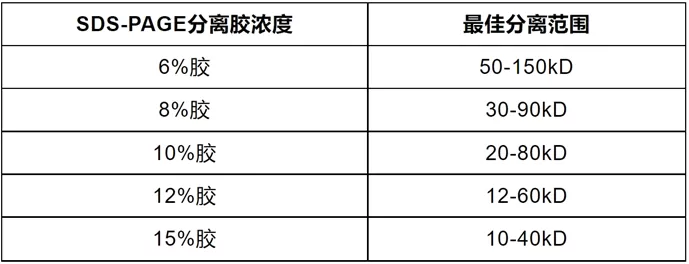
选择合适的分离胶(下层胶)浓度
- 根据目的蛋白的分子量大小选择
丙烯酰胺
- 与为蛋白质电泳提供载体,其凝固的好坏直接关系到电泳成功与否,与促凝剂及环境密切相关
- 有毒,进入人体后,会在体内与DNA上的鸟嘌呤结合形成复合物,导致遗传物质损伤和基因突变。
β-巯基乙醇
- 作为还原剂添加入样品中,可以还原(分解)存在于蛋白质的肽链上半胱氨酸残基之间的二硫键(S-S键)。S-S键使蛋白质折叠形成二级结构。因为蛋白的构象会干扰电泳的迁移率。所以,当电泳时,消除蛋白构象对迁移率的干扰非常重要。β-巯基乙醇还原蛋白的二硫键为游离的-SH,样本中所有的蛋白都变成线性的一级结构,使其电泳迁移率只与蛋白分子量有关。
十二烷基硫酸钠(SDS)
- 将SDS混合在样品缓冲液中。蛋白样本用β-巯基乙醇处理后解聚成单一线性;用SDS处理后,所有蛋白质均只带负电荷。SDS可以使所有的蛋白质分子均匀的带上负电荷
- 当施加电压时,所有的蛋白质都向凝胶的正极迁移。因为,不同大小的蛋白质得到的负电荷与其分子量成正比,它们只因为分子量大小的不同而分离开,而不是因为带电荷的多少或者蛋白构象。在凝胶中也存在SDS,这是为了确保所有的蛋白质在整个凝胶中保持荷载负电荷。
- 作为阳离子去污剂,作用有四:去蛋白质电荷、解离蛋白质之间的氢键、取消蛋白分子内的疏水作用、去多肽折叠。
- 对粘膜和上呼吸道有刺激作用,对眼和皮肤有刺激作用,可引起呼吸系统过敏性反应。
过硫酸铵(APS)
- 过硫酸铵是提供形成自由基的硫酸盐基团的。这些用于自由基生成的硫酸盐由过硫酸铵提供
- 对黏膜、上呼吸道组织、眼睛和皮肤具有极大的危害性。眼、皮肤接触可引起强烈刺激、疼痛甚至灼伤,吸入可致命。
TEMED·(N,·N,·N',·N'-tetramethylethylenediamine)
- 凝胶的聚合是通过自由基机制发生的。TEMED(N,N,N,N-四甲基乙二胺)作为催化剂,生成硫酸盐自由基。
- 具有腐蚀性、挥发性、强神经毒性。
操作步骤
蛋白样品制备
组织中总蛋白的提取
组织蛋白获取
- 敲取0.07-0.1g组织+400-500ul裂解液
- 放入打样机打样
- 实验室研钵研磨
- 取稍大于0.1g的样品放入研钵中,来回磨,至粉末状,用枪头刮取收集入离心管
细胞
- 去除上清液
- 冷PBS洗2次
- 0.25%的胰酶消化后转移至EP管中离心
- 冷PBS洗2次
- 加入100~300·µL含有蛋白酶抑制剂的细胞裂解液
- 裂解30min,每10min吹打一次
- 离心,取蛋白上清
取出的样品放置冰上1-2h
- (中间混匀5-6次)直至裂解完全
样品离心*2
- 离心条件:13000rpm,4℃,30min
- 离心机提前预冷至4℃
取上清于新的EP管中
只谈经验
- 好的蛋白是WB成功的一半
- 快速彻底裂解,先变性后保存
- 尽量选择足够强的裂解液(如RIPA裂解液)
- 合适的盐浓度下,保持蛋白质的最大溶解性和可重复性
- 尽量除去核酸,多糖,脂类等干扰分子
- 提取蛋白质过程中,应在低温环境下进行,以抑制蛋白酶的水解作用(可加入适合的蛋白酶抑制剂)
- 蛋白样品建议分装后冷冻干燥或直接以液体态置-80℃中保存,不要反复冻融
- 蛋白浓度低时,可使用超滤膜浓缩或者用真空冻干机将蛋白冻干
蛋白含量的测定
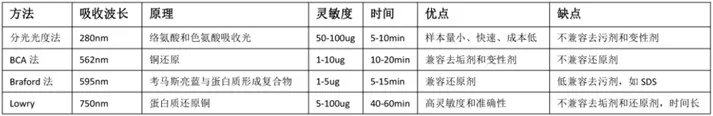
- 确保每个蛋白样品的上样量一致
96孔板第一列1-8
- 浓度为0,1,2,4,6,8,9,10倍的蛋白标准液+水=10或20ml
- 加上5倍稀释的考马斯亮蓝染液200ml
96孔板后面几列
- 依次加入稀释的蛋白样品或原液10-20ml
- 5倍稀释的考马斯亮蓝染液200ml
确保每个蛋白样品的上样量一致
SDS-PAGE电泳
概念
- 十二烷基硫酸钠聚丙烯酰胺凝胶电泳(英语:sodium·dodecyl·sulfate·polyacrylamide·gel·electrophoresis,简称SDS-PAGE)是胶体电泳的一种,常用于生物化学、鉴识科学、遗传学和分子生物学等领域的分析技术,此项技术的原理,是利用蛋白质分子量大小的不同,使其在电泳胶中分离,是最常用的蛋白质分析技术之一
- 在SDS-PAGE中使用的凝胶是聚丙烯酰胺(polyacrylamide),使蛋白质呈线性化的试剂是SDS。因此得名SDS-PAGE
原理
刷板
验漏
- 待电泳槽安装完毕
- 缓慢注入少量蒸馏水
- 15s内没有漏液倒掉蒸馏水
- 吸水纸将残留的水吸干净
配胶
装板
- 玻璃板对齐后放入夹中卡紧
- 垂直卡在架子上准备灌胶
配分离胶
- 加入TEMED后立即摇匀
- 灌胶至胶面升到玻璃板3/4位置
- 胶上加一层水
- 液封后的胶凝的更快
- 加水液封时要很慢,否则胶会被冲变型
- 等水和胶之间有一条折射线说明胶已凝了
- 倒去胶上层水并用吸水纸将水吸干
配浓缩胶
- 加入TEMED后立即摇匀
- 将剩余空间灌满浓缩胶
- 梳子插入浓缩胶中
- 插梳子时要使梳子保持水平
- 等浓缩胶凝固
- 两手分别捏住梳子的两边竖直向上轻轻拔出
- 水冲洗浓缩胶
装电泳槽
- 小玻璃板面向内
- 若只跑一块胶,槽另一边要垫一块塑料板且有字的一面面向外
上样
- 计算含50mg蛋白的溶液体积(上样量)
- 适量蛋白加入4:1··5*Loading·Buffer于离心管
- 100℃水中煮5min使蛋白变性
- 放置冰上3min
- 离心15min,13000rpm,4℃
- 加足够的1*电泳缓冲液后开始准备上样
- 电泳液至少要漫过内测的小玻璃板
- 用微量进样器贴壁吸取样品
- 不要吸进气泡
- 将加样器针头插至加样孔中缓慢加入样品
- 加样太快可使样品冲出加样孔,若有气泡也可能使样品溢出
电泳
- 浓缩胶80V电压跑20分钟
- 分离胶180V电压跑至底端
- 停止电泳
清洗回收物品
- 纯水冲洗玻璃板
- 取胶,清洗切去浓缩胶
- 在Marker下方切角做标记
- 将胶泡在清水中
只谈经验
- 胶最好现配现用
- 如果需要保存,最好用湿润的保鲜膜包好并置于4℃冰箱中
- 设置内参
- 检测整个实验系统或校准实验结果
- 一般指由管家基因编码表达的蛋白
- 内参选择原则
- 设置合适正确的对照
- 确保western·blot结果的准确性和特异性
- 阳性对照
- 明确表达检测蛋白的组织或细胞,用于检测抗体的工作效率
- 阴性对照
- 明确不表达检测蛋白组织或细胞,用于检测抗体的特异性
- 二抗对照
- 不加一抗,用于检测二抗的特异性
- 内参对照
- 检测标本的质量和二抗系统
- 空白对照
- 不加一抗和二抗;用于检测膜的性质和封闭的效果
转膜
- 跑胶时准备转膜用品,最主要赶气泡
- western·blot成败的关键
NC膜
- 在低离子转移缓冲液的环境下,大多数带负电荷的蛋白质会与NC膜发生疏水作用而结合在一起,具有很高的亲和力。且易于封闭非特异性结合。在非离子去污剂的作用下,结合的蛋白易于被洗脱。当然,根据被转移的蛋白分子量大小,要选择不同孔径的NC膜。
PVDF膜
- PVDF膜是一种疏水性聚合物,在水溶液中不会被浸湿,为了在水性缓冲液中使用PVDF膜,首先需将其浸泡在50%(v/v)的醇溶液中(甲醇、乙醇和异丙醇),浸泡后会活化膜上的正点基团,使其更易与带负电荷的蛋白结合。
- 同样,根据被转移的蛋白分子量大小,要选择不同孔径的PVDF膜。
剪PVDF膜
- 提前切个角
甲醇中泡2-3min
膜、海绵、滤纸一起泡入1*转膜液中
- 转膜液可回收
放4℃保存
装配夹子
- 黑胶白膜
- 半干转移:纸>凝胶>膜>纸(均用转移缓冲液浸湿);
- ·············湿转移:海绵>纸>凝胶>膜>纸>海绵(全程在转移缓冲液中浸泡)
- 夹子打开使黑的一面保持水平
- 上面垫一张海绵垫,玻棒擀去气泡
- 另一手要压住垫子使其不能随便移动
- 垫子上垫2层滤纸,玻棒擀去气泡
- 胶盖于滤纸上,玻棒擀去气泡
- 将膜用镊子盖于胶上,并除气泡
- 膜上盖2层滤纸并除去气泡
- 盖上另一个海绵垫
- 合起夹子
装配转膜槽
- 夹子放入转膜槽
- 黑对黑,红对红
- 转膜槽中放入冰盒
- 电转移时会产热,过热有可能造成蛋白质的降解,同时大量产热,会使凝胶膨胀,有可能在胶和膜之间产生空隙,引起转膜不均匀,所以在转膜槽中放入冰盒,在冰水混合物中进行转膜
- 转膜条件
- 电流300mA或电压70V,2h
- 电压必须控制在60-70V,调节电流
转膜
清洗回收物品
- 膜放入装水的小盒中冲洗
- 加5%的封闭液
- 摇床封闭1h
只谈经验
- 胶在负极,膜靠近正极
- 滤纸不要大过膜,防止短路
- 夹好膜和凝胶后,确定在凝胶、膜和滤纸之间没有气泡存在,否则会导致转膜不完全
- 一定要戴手套或塑料镊子接触膜
- 避免手上的蛋白和油脂降低转膜效率
- 最好把转膜槽放置在冰浴中进行转膜
- 湿转法
- 转膜的电流在200mA-400mA之间
- 转膜时间为30-60分钟
- 可以在15-20mA转膜过夜
- 大片段的>50KD的可以选用350mA,小片段的可以用250mA
- 转膜时间要根据目的蛋白的大小而定
- 目的蛋白的分子量越大,需要的转膜时间越长,目的蛋白的分子量越小,需要的转膜时间越短
抗体孵育
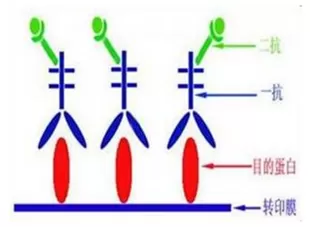
孵一抗
只有目的蛋白才能与一抗结合形成抗原抗体复合物
- 回收封闭液
- 加入一抗
- 摇床30min-1h
- 4℃过夜
- 孵育30min-1h
- 一抗回收
- PBST洗,洗5次,每次5min
孵二抗
二抗: 一抗的抗体,如一抗是鼠一抗,则二抗就是抗鼠IgG的抗体
带有酶(碱性磷酸酶、辣根过氧化物酶)标记的二抗(也是俗称的酶标二抗)与一抗结合形成抗体复合物;
可用来指示一抗的位置,也即指示了目的蛋白的位置
- 加二抗
- 孵育2h
- 二抗回收
- PBST洗,洗5次,每次5min
- 纯水冲洗5-7次
- 倒掉纯水
- 加化学发光浸泡2-3min
只谈经验
- 封闭液的选取具体得看抗体说明书
- 封闭液浓度的选择也是具体得看抗体的要求
- 一般情况5%BSA会比5%牛奶的效果好
- 抗体选择
成像
WB结果定量分析
- Quantiy·One
- ImageJ
- 灰度分析
- 密度分析
常见问题
胶不平或漏液
- 胶板洗刷干净
- 加入AP和TEMED的量要合适
- 加入试剂后摇匀,使其充分混合,防止部分胶块聚合不均匀
- 温度合适,受热不均匀导致胶聚合不均匀
- 两块玻璃板底部要对齐
条带比正常的窄,“微笑”或“倒微笑”条带
- 凝胶聚合不均匀
- 拔梳子要迅速
- 清洗加样孔要小心,以免把上样带扭曲
- 纯化样品,调整盐浓度
- 样品盐浓度过高会挤压其他条带导致宽窄不一
- 赶走气泡
- 胶板底部有气泡会影响电泳效果
- 注意电泳槽装置是否合适
电泳的条带很粗
- 主要是未浓缩好
- 适当增加浓缩胶的长度
- 保证浓缩胶贮液的pH正确(6.7)
- 适当降低电压
凝胶肿胀或卷曲,条带歪斜或漂移,单个或多个白点,转膜缓冲液过热
- 将凝胶在转膜之前放到转膜缓冲液中浸泡5-10min
- 在两块海绵之间垫上少许普通的草纸
- 确保膜和胶块之间没有气泡
- 缓冲液中离子浓度太低
- 电流或电压太高
转移到膜上的蛋白很少
- 蛋白分子量<10KD
- 减少转膜时间
- 使用小孔径的膜
- 蛋白的等电点<9
- 更高pH值Buffer
- SDS浓度不合适
- 在极buffer中加入0.005-0.01%SDS可提高转膜效率
- 凝胶太厚
- 延长转膜时间
背景太高
- 膜没有均匀浸湿
- 转膜前用100%甲醇将膜完全浸湿
- 膜或者缓冲液污染
- 拿取膜与吸水纸时要戴手套,更换新鲜转膜缓冲液
- 抗体与封闭剂出现交叉反应
- 检测一抗、二抗与封闭剂是否有交叉反应
- 抗体浓度过高
- 杂交前检测一抗、二抗的工作浓度
杂交信号很弱
- 抗体保存不当
- 抗体长期保存应在-70℃,使用前做效价检测
- 抗原不充足
- 增加蛋白上样量,做已知标准量蛋白的对照
- 膜的漂洗过度
- 减少漂洗的时间和次数
出现非特异带
- 一抗不是唯一特异的
- 制备单克隆抗体或者重新选取合成抗原多肽的位点
- 二抗出现非特异结合
- 设立不加一抗,只加二抗的平行对照来检测二抗是否有非特异结合
电泳电压很高而电流却很低
- 电泳槽没有正确装配
- 内外槽装反
- 外槽液过少
- 电泳槽底部的绝缘体未去掉(比如倒胶用的橡胶皮)
只谈经验
根据个人使用量将RIPA分装保存
- 避免反复冻融,但是不要将PMSF和RIPA混合后再分装,这样会影响PMSF的作用效果
在同一厂家购买丙烯酰胺,同时注意4度避光保存
快速转膜液
阅读剩余
版权声明:
作者:
链接:https://yunshangtulv.com.cn/?p=332
文章版权归作者所有,未经允许请勿转载。
THE END