细胞计数
本页内容综合整理自网络,仅作学习所用。
背景知识
常用的计数方法
- 手工计数(如改良牛鲍计数板)
- 细胞计数仪计数(经费充裕的课题组常备)
- 流式细胞仪计数
基础理论知识
细胞计数板结构
改良牛鲍计数板
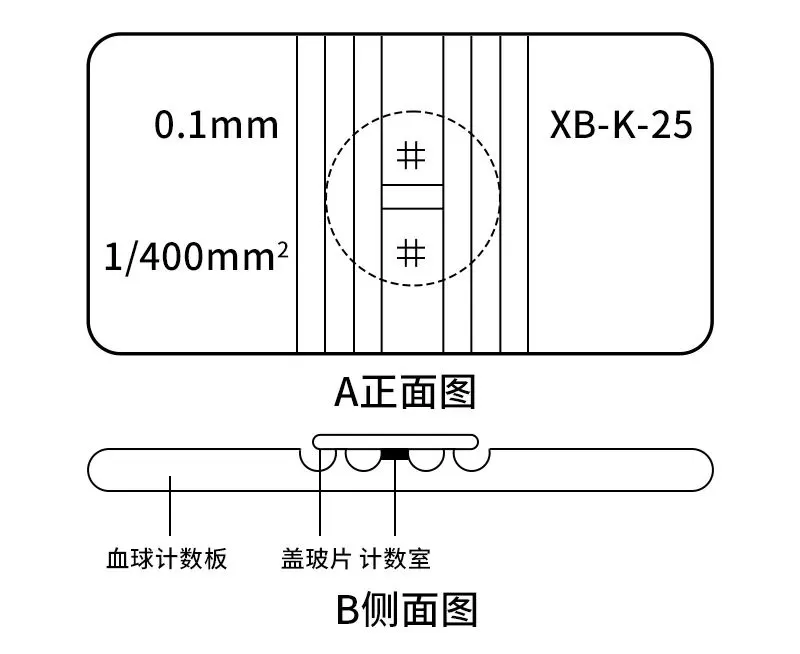
- “H”形凹槽,分为2个同样的计数池
- 计数池两侧各有一条支持柱,将特制的专用盖玻片覆盖其上,形成高0.10mm的计数池。
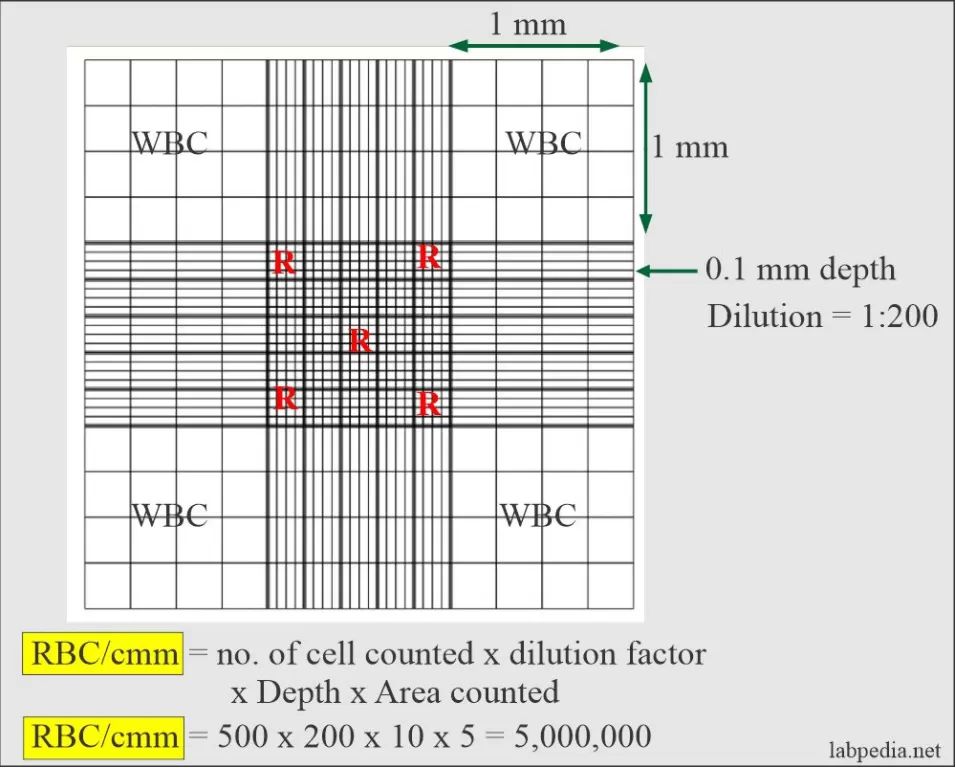
- 计数池内划有长、宽各3.0mm的方格,分9个大格。
- 每个大格面积为1.0毫米X1.0毫米=1.0平方毫米;容积为1.0平方毫米X0.1毫米=0.1立方毫米。
- 在进行细胞计数时,主要计数四角的4个大方格的区域,用单线划分为16 个中方格。

应用范围
操作步骤
计数板处理
- 用无水乙醇(或 95%)擦拭计数板,取一张干净盖玻片覆在计数板上。
制备细胞悬液
- 加入0.25%胰蛋白酶-0.02%EDTA混合消化液1mL,静置3~5分钟,待见到细胞变圆,彼此不连接为止,轻轻进行吹打,制成细胞悬液。
- 稀释至合适倍数。如果细胞数量较多的情况下,可取一滴(或100μl)细胞混悬液+八滴(或800ul)细胞培养液+一滴(或100μl)苔盼蓝,这样最终稀释倍数为十倍。
染色
- 吸取 0.4% 台盼蓝染液,按 1∶1 比例,从计数板边缘缓缓滴入,使之充满计数板和盖片空隙。如有气泡则要重做。将计数板放在低倍镜下(10 × 10 倍)观察计数。
充池
- 将细胞计数板擦拭干净,吸取10ul细胞混悬液滴加至计数池边缘,液滴通过虹吸作用进入盖玻片下方,将计数板静置5分钟左右。
计数
- 在低倍镜(10×10倍)下,观察充池的细胞分布是否均匀,若充池不均匀则需重新充池。随后计数四个大方格中的细胞
计数原则
- 数上不数下,数左不数右
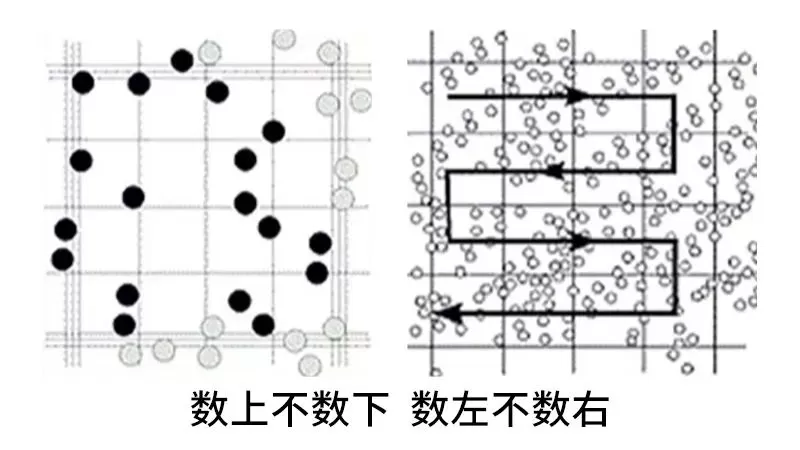
- 只计数完整的细胞,聚成一团的细胞则按一个进行计数
计算换算
- 计数后,需换算出每 ml 悬液中的细胞数。由于计数板中每一方格的面积为 0.01 cm²,高为 0.01 cm,这样它的体积为 0.1 mm³。由于 1 ml = 1,000 mm³,故每一大方格内细胞数 × 10,000 = 细胞数/ml
没有使用台盼兰染色
- 细胞悬液细胞数/mL=(N总/4)×10^4×稀释倍数
使用台盼兰染色,需计算活细胞的百分率:
- 活细胞百分率(%)=台盼兰拒染细胞数/总细胞数×100%
活细胞数的计算公式:
- 细胞悬液活细胞数/mL=(N总/4)×活细胞比率×10^4×稀释倍数×2
只谈经验
计数板和盖玻片用75%酒精擦干净并晾干。
充池时,建议使用10ul枪头
需要注意充池的手法,要干净利落
- 不能过重地加液,否则会导致细胞充池不均匀
- 也不能过轻,否则容易充不进去或者产生气泡
- 亦不能用枪头挑盖玻片,否则也容易充池不均,产生较大计数误差
- 加量适当,过多易使盖片漂移,或淹过盖片则需重做
计数的最适浓度为5~10×10^5细胞/ml
- 若细胞悬液浓度过高,则需要合理稀释
- 若细胞浓度过低,则需要离心后取合适培养液重悬。
- 只计数完整的活细胞,染成蓝色或折光性较弱的细胞均不能计数,聚成一团则按照一个细胞计数,两次重复计数误差通常不大于5%。
计算时明确需要进行实验的细胞数
- 可以通过提前设定所需细胞数量,计算得出细胞密度之后,加入相应体积的细胞悬液
- 应用举例:在铺24孔板时,若每孔需要1.0×10^5个细胞,24孔则需要2.4×10^6个细胞,通常会多计算一个孔的细胞数,则总共需要2.5×10^6个细胞。若稀释10倍之后,进行细胞计数后,N总为100个(此为细胞计数的四个大方格总数),则需要1ml该细胞悬液进行铺板(注意,最后会剩余1个孔的细胞量,所以会有细胞悬液残余),即N=C×V,此处N为所需细胞总数,C为细胞悬液密度,V为细胞悬液体积。
在细胞计数过程中充分混匀细胞悬液
- 细胞不宜在室温太久,吹打次数过多也会损伤细胞,导致细胞状态不好。
- 若方格中细胞分布明显不均,说明细胞悬液混合不均匀,需重新将细胞悬液进行混合,再计数
二次重复计数误差不应超过 ±5%
阅读剩余
版权声明:
作者:
链接:https://yunshangtulv.com.cn/?p=353
文章版权归作者所有,未经允许请勿转载。
THE END