实验小白成长路:克隆形成实验
背景知识
背景知识
克隆形成实验是研究细胞增殖能力和存活率的有效方法之一。贴壁后的细胞不一定每个都能增殖和形成克隆,而形成克隆的细胞必为贴壁和有增殖活力的细胞。
通过观察单个细胞在体外培养环境下的增殖和克隆形成情况,可以评估细胞的增殖能力和群体依赖性。
该实验包括平板克隆形成实验和软琼脂克隆形成实验,分别适用于不同类型的细胞。
基础理论知识
基础理论知识
克隆形成
克隆形成是指单个细胞在体外持续分裂繁殖超过6代后,其后代组成的细胞群。光镜下,大于50个细胞,计数为1克隆。,大小在0.3-1.0 mm之间。
克隆形成率是指接种细胞后,成活并形成克隆的细胞数占总接种细胞数的百分比。反映细胞群体依赖性和增殖能力两个重要性状。
增殖能力
细胞增殖能力是指细胞在适宜条件下进行有丝分裂的能力。通过计算克隆形成率,可以评估细胞的增殖能力。
群体依赖性
群体依赖性指的是细胞是否需要相互作用才能形成克隆。克隆形成率也能反映细胞的独立生存能力和群体依赖性。
应用范围
应用范围
- 评估细胞增殖能力
- 研究细胞群体依赖性
- 筛选药物和治疗方案的有效性
- 评估细胞在体内形成肿瘤的潜力:癌细胞不一定都可以在体内成瘤,但若体外克隆能力越强,即表明体内成瘤性越强,算是模拟体内成瘤的体外实验。
基本原理
基本原理
平板克隆形成实验(Colony Formation on Solid Media)
适用于贴壁生长的细胞,通过计数克隆数来评估细胞的增殖能力和群体依赖性。
软琼脂克隆形成实验(Soft Agar Colony Formation)
适用于悬浮生长的细胞和肿瘤细胞,通过在琼脂中形成克隆来评估细胞的增殖能力和恶性程度。正常细胞依靠细胞与细胞外基质的接触才能生长和分裂,相反,不管周围环境如何,转化细胞均具有生长和分化的能力,因此能够以锚定独立的方式形成菌落的细胞被认为是转化和致癌的。这种方法的总体目标是以半定量和严格的方式测定细胞的这种能力。
设备耗材
设备耗材
平板克隆形成实验
- 0.25% 胰酶溶液
- 含10% 胎牛血清的培养基
- PBS 溶液
- 4% 多聚甲醛溶液
- 结晶紫染液或姬姆萨染液:结晶紫是碱性染料,可以与核酸结合把细胞核染成蓝色,便于观察及计数
- 6孔板
软琼脂克隆形成实验
- 0.25% 胰酶溶液
- 含10% 胎牛血清的培养基
- PBS 溶液
- 超纯水
- 低熔点琼脂糖
- 2×完全培养基
- 6孔板
实验准备
实验准备
平板克隆形成实验
染液配方
- 10×Giemsa染色液:Giemsa粉末0.8g 溶于50mL甲醇,完全溶解后加入50mL甘油,摇匀,37℃-40℃水浴8-12h,棕色瓶常温保存,用时取1份Giemsa原液溶于9份PBS中。
- 0.1% 结晶紫染色液:称取1g结晶紫粉末,用甲醇定容到100mL,避光常温保存。
软琼脂克隆形成实验
- 配制1.2% 和0.7%琼脂糖溶液,高压灭菌,维持在40℃防止凝固。
操作步骤
操作步骤
平板克隆形成实验
制备细胞悬液
- 将对数生长期的单层细胞常规消化离心收集细胞沉淀,重悬细胞沉淀,计数,稀释至1×10³个/mL。
接种细胞
- 以每孔50、100、200个细胞的梯度密度接种六孔板中,补加3mL培养基,置于37℃,5% CO₂培养箱中培养,静置培养2-3周。经常观察,当培养皿中出现肉眼可见的克隆时,终止培养
染色
- 当培养皿中出现肉眼可见的克隆时,停止培养,弃掉培养基,用PBS小心洗涤2-3次,弃掉PBS。每孔加入4%多聚甲醛1mL,固定15min,弃固定液。PBS洗涤。每孔加入1mL 0.1%结晶紫或Giemsa染色液染色10-30min,流水缓慢洗去染液,空气干燥。
计数
- 显微镜下计数含50个细胞以上的克隆数并拍照,取3个复孔的克隆平均值进行计算。
- 克隆形成率 =(克隆数 / 接种细胞数)× 100%
结果展示

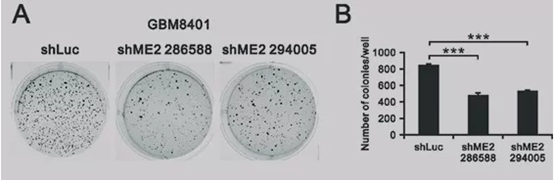
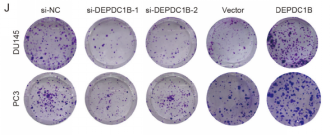
图片来源网络,侵删
软琼脂克隆形成实验
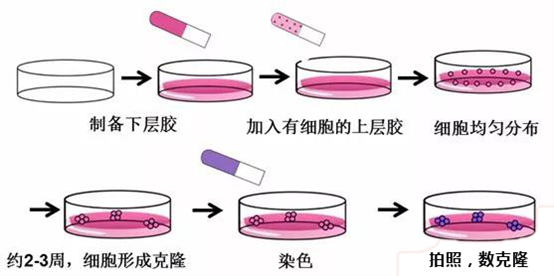
图片来源网络,侵删
制备细胞悬液
- 将对数生长期的单层细胞常规消化离心收集细胞沉淀,重悬细胞沉淀,计数,稀释至1×10³个/mL。
配置琼脂
- 用蒸馏水分别制备出1.2%和0.7%两个浓度的低熔点琼脂糖溶液,高压灭菌后,维持在40℃防止凝固。
- 铺下胶:按1:1比例混合1.2%琼脂糖和2×完全培养基(含2×抗生素和20%胎牛血清),取1.5mL加入6孔板中,冷却凝固,作底层琼脂置于培养箱中备用。作为支撑防止细胞贴附生长。
接种细胞
- 铺上胶:按1:1比例混合0.7%琼脂糖和2×完全培养基,再向混合液中加入0.2mL细胞悬液,充分混匀,注入铺有1.2%琼脂糖底层的孔板中,形成双琼脂层。最后加一层培养基以防干燥并补充营养。上层胶细胞数目根据不同的细胞类型而定。通常,使用5000个细胞/孔作为起始浓度,但可以根据需要进行调整。作为营养补充剂以及为防止下层琼脂胶干燥。
培养
- 室温静置30 min,待上层琼脂凝固后,置于培养箱中培养2-3周。
观察与计数
- 以肉眼可见的细胞团作为计数集落的标准,计算集落形成率。
Image J软件计数方法:
- 点击File→Open→打开图片。(也可将图片直接拖动到菜单栏,即可打开。)
- 将图像转为8-bit
- 点击Image→Type→8-bit,此时图片即已被去色。
- 调整阈值,去除背景,选中细胞
点击Image→Adjust→Threshold对阈值进行调整,主要是为了选择细胞区域;
选择B&W(Black and White),图像中黑色的区域就是已经选中的区域。(这里可以进行更改,如若改为red,则红色区域为选中的区域。)
另外我们发现Threshold窗口中有两个调节框,我们可以通过左右拖动调节框中的滑块对选择的区域进行调整。原则是尽可能的包含所有的细胞同时去除背景中的杂质。
拖动完成后点击Apply,这样阈值就设置好了。
- 若出现细胞重叠或者贴近的情况,软件识别时将两个粘连在一起的细胞识别为一个,这时可以利用Watershed自动识别重叠部分,随后再将两个细胞分离开来。
点击Process→Binary→Watershed,这样粘连的细胞会被分开。
- 计数颗粒
点击Analyze→Analyze Particles,出现Analyze Particles界面,根据处理图像的不同,设置不同的参数。
Size:0.05-Infinity——指分析颗粒尺寸大于0.05
Circularity:0.00-1.00——指圆度,可以根据细胞形状,调整需要的圆度,1.00为标准圆,一般情况下只根据Size进行限制就可以了。
Show:Overlay——指原本图片上会展示出分析结果的外框。
Exclude on edges:——处于边缘的颗粒不计入。
注意事项
注意事项
- 缓冲液清洗和固定时沿着孔板侧壁加入,不要吹掉细胞。
- 细胞悬液中单个分散细胞应多于90%,平板培养早期尽不要晃动培养皿,以晚细胞脱落,导致实验误差增加。
- 染色前固定液要吸干净,避免局部残留固定液将染剂稀释造成染色不均一。
- 染色完成后,务必将染液清洗干净,不要在孔中有残留。
平板克隆形成实验
- 细胞成团:制备单细胞悬液时需充分吹打分散细胞。
- 接种密度过高:会导致多个克隆融合,影响计数结果。需预实验确定最佳接种密度。
- 染色不均匀:染色液要充分覆盖细胞,染色时间控制适当。
- 培养基更换:定期观察培养基的颜色及污染情况,必要时更换。
软琼脂克隆形成实验
- 琼脂温度:琼脂与培养基混合时温度不宜超过40℃,以免烫死细胞。
- 操作速度:操作过程中需迅速,以防局部结块。
- 细胞密度:上层琼脂中的细胞密度需根据细胞类型调整,一般以每孔200个细胞为宜。
- 琼脂毒性:琼脂经灭菌后应分装备用,反复加热易导致琼脂降解而产生毒性,且其硬度也会有所下降,因此高压灭菌后应进行分装。
只谈经验
只谈经验
拍照时,务必使每个孔中无阴影,如无法达到,则逐个孔进行拍照。
细胞计数时建议多计数几次。
平板克隆形成实验
- 均匀接种:确保细胞接种均匀是实验成功的关键。
- 减少扰动:培养过程中不要频繁移动培养皿,以免细胞脱落。
- 适量染色:染色时注意时间和染色液的用量,确保染色均匀。
软琼脂克隆形成实验
- 温度控制:琼脂与细胞混合时温度要适中,操作要快,避免局部结块。
- 凝固后操作:确保上下层琼脂完全凝固后再进行下一步操作。
- 合适密度:选择合适的细胞密度,确保结果准确。
常见问题
常见问题
细胞未形成克隆:并非每种细胞都可以形成克隆,克隆形成率与细胞本身增殖能力有关。还与接种细胞密度,加入培养液的体积、血清浓度有关。因该实验处理时间较长,应给细胞多加培养基,如每孔4ml,或者3天更换一次培养基,以供给细胞充足的营养。
平板克隆形成实验
- 细胞成团:制备单细胞悬液时需充分吹打分散细胞。
- 接种密度过高:会导致多个克隆融合,影响计数结果。需预实验确定最佳接种密度。
- 染色不均匀:染色液要充分覆盖细胞,染色时间控制适当。
软琼脂克隆形成实验
- 琼脂温度过高或过低:过高会烫死细胞,过低会导致局部结块。琼脂与培养基混合时温度不宜超过40℃。
- 细胞密度不合适:细胞密度过高或过低都会影响结果,需根据细胞类型调整密度。
- 操作速度慢:操作过程中需迅速,以防琼脂局部凝固。
软琼脂克隆形成失败的原因:细胞自身的因素,半固体环境要求细胞恶性程度高,容易生长,恶性程度低且依赖贴壁生长的细胞可能不适用于此法。
通过以上详细步骤和注意事项,可以有效地进行克隆形成实验,从而评估细胞的增殖能力和群体依赖性。
参考文献:
Wang J, Zhang N, Han Q, et al. Pin1 inhibition reverses the acquired resistance of human hepatocellular carcinoma cells to Regorafenib via the Gli1/Snail/E-cadherin pathway. Cancer Lett. 2019;444:82-93. doi:10.1016/j.canlet.2018.12.010IF: 9.1 Q1
Gan Y, Deng J, Hao Q, et al. UTP11 deficiency suppresses cancer development via nucleolar stress and ferroptosis. Redox Biol. 2023;62:102705. doi:10.1016/j.redox.2023.102705IF: 10.7 Q1
Xu M, Chen X, Lin K, et al. The long noncoding RNA SNHG1 regulates colorectal cancer cell growth through interactions with EZH2 and miR-154-5p. Mol Cancer. 2018;17(1):141.
Singh M, Bansal S, Kundu S, et al. Synthesis, Structure-Activity Relationship, and Mechanistic Investigation of Lithocholic Acid Amphiphiles for Colon Cancer Therapy. Medchemcomm. 2015;6(1):192-201.
Baldeyron C, Brisson A, Tesson B, et al. TIPIN depletion leads to apoptosis in breast cancer cells. Mol Oncol. 2015;9(8):1580-1598.
Willmer T, Cooper A, Sims D, Govender D, Prince S. The T-box transcription factor 3 is a promising biomarker and a key regulator of the oncogenic phenotype of a diverse range of sarcoma subtypes. Oncogenesis. 2016;5(2):e199.